今回のテーマは、pKa(酸解離定数)です。
pKaは高校でも習いますが、意外に意味を忘れていたり、使い方がピンとこなかったりしていませんか?
薬物動態学でも、pKaの考え方をしっかり理解していないと困る場面があるので解説していきたいと思います!
目次
酸と塩基とは?
「酸解離定数」という文字通り、「酸性」の物質についての特性です。
実は、「酸性」といってもいろんな定義があります。その中でも、pKaを考えるときはブレンステッド・ローリーの定義を使っていきます。
ブレンステッド・ローリーの定義って!?という人はもう一度復習してみてください!
簡単に言うと、「H+」(プロトン)を与えるのが「酸」、受けとるのが「塩基」ですよ、という定義です。
中学校や高校の勉強では、「H+」を出すのが酸であり「OH–」を出すのが塩基(アルカリ)と考えることもありました。
しかし、薬学にでてくる酸・塩基は「H+」が離れるのか、戻るのか、という観点でみていきます。(特に分子のイオン型と非イオン型を考えるときは)
ここまでが前提になる考え方になるので、しっかり整理しておきましょう。
pKaとは?
では、さっそくpKaの考え方に入っていきましょう!
HAという酸性物質があったとき、その解離の様子を式にあらわすと下のようになります。
HA ⇔ H+ + A–
両辺の濃度の比は一定条件下では定数となり、下の式のように表して酸解離定数(Ka)と呼んでいます。(⇒なんで?って方はこちら)
この式に数値をいれて計算してもらうと分かりますが、[H+]やKaの数値が0.000001など、非常に扱いづらい数字になってしまいます。
それを回避するために、両辺の対数をとるわけです。たとえば、0.000001=10-6なので、-log10をとると「6」になって扱いやすくなりますよね!
さらに、-log10を「p」と表現して一部を書きかえると、おなじみの「pH」や「pKa」が登場する式になります。
ここで、酸の解離がちょうど半分になるとき、つまり、「HA」のちょうど半分が「H+」を放出したときを考えます。
当然ですが、[A-]と[HA]が等しくなりますね。
すると、
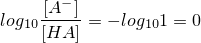
となり、上の①式に代入してみると、pH=pKaとなります。つまり、この時のpHはpKaと等しくなるんですね!
このように、pKaの定義は、「酸全体のちょうど半分の分子が解離した時のpH」と言えるわけです。
pKaの使い方
では、次にpKaは実際にどのように使えるの?という話に移っていきます。
例えば、pKaが4の酸性物質があったとします。(乳酸とかがだいたいこのぐらいのpKaをもちます)
この酸をpH5の溶液に溶かすしたらどうなるでしょう?
単純なイメージとして、pH4で半分の分子がH+を放出するんだから、それよりもアルカリに傾くと・・・
もちろん、さらに多くの分子がH+を手放しますよね。具体的に①式に代入すると、
5(pH)=4(pKa)+log10[A-]/[HA]
∴log10[A-]/[HA]=1
∴[A-]/[HA]=10
∴[A-] : [HA]=10 : 1
となります。
これってどういうことなのでしょう?
最初の条件をふりかえると、pHがpKaよりも1だけ大きい値でした。
そして計算結果をみると、[A-] : [HA]=10 : 1となってます。つまりこれは、イオン型分子(A-)が非イオン型分子の10倍量になっているっていうことなのです!
薬物動態学で考える
ここでちょっとだけ薬物動態学とからめた話をします。上の酸性物質が、仮に「薬」だったらどうなるかを考えていきましょう。
一般的に体や細胞に吸収されやすいのは、脂溶性(=非イオン性)分子です。なぜなら、人の体の細胞膜は「脂質」でできているからです。
上の計算結果から、消化管のpHが1上がるだけで、非イオン型分子が激減し、一方でイオン型分子は激増しました。
細胞膜を通って体内に吸収されるのは、非イオン型でしたから、薬の吸収性はがた落ちしてしまいます。
例えば、胃酸を抑える薬を使って、胃内のpHを上げた場合、これと同様のことが実際に身体のなかで起こりえるのです。
(※この例はかなり話を単純化しています。)
これが、pKaの実用的な使い方の一つの例になります。
物質ごとのpKaの値と溶したい溶液のpHが分かれば、イオン型と非イオン型の割合が分かってしまうわけですね。
簡単にまとめると、酸性物質の場合、
pH < pKaのときは「非イオン型」になっているものが多く、
pH > pKaのときは「イオン型」になっているものが多い。
塩基性物質の場合は?
さらに、この考え方は塩基性の物質でも使うことがあります。
塩基は「H+」を受け取るものでしたよね。例として、アンモニアはH+を受け取ると「NH4+」となって、これは酸になります。
ただし、この時は酸のときとは逆に考えないといけません。NH4+は「H+」を手放す前は「イオン型」で、手放すと「NH3」=分子型になります。
なので塩基性物質のpKaを考えるときは、
pHがpKaよりも小さいときは「イオン型」になっているものが多く、
pHがpKaよりも大きいときは「非イオン型」になっているものが多い。
となるわけですね。
塩基性物質の場合、pKaに相当するpKb(塩基:base)というものを使うこともあります。
以上、なるべく分かりやすくpKaとpHの関係について説明したつもりです。
不明な点があればコメントをお願いします。最後までお読みいただきありがとうございました!

コメント
初めまして
非常に解り易い解説でいつも勉強させていただいております。
突然ですが、Pkaについて質問したいことありコメントさせて頂きます。授乳と薬についてPkaを勉強しているのですが、いまひとつ解りません。Pkaが7.4以下だと移行が少ないように書いてあるものもあるのですが、酸性物質か塩基性物質かで結果は変わってくると思います。血液PH7.4のときPKaがそれ以下であれば酸性物質はイオン型が多くなり移行しづらいですが、塩基性物質であれば分子型が多くなり逆に移行しやすいと思われます。Pkaをみただけでは判断できないのでしょうか?また酸性か塩基性かはどのように判別できるのでしょうか?化学が苦手で的外れな質問かもしれませんが、もしよろしければご教示頂けるとたいへん助かります。どうぞよろしくお願い申し上げます。
>すずきさん
質問をいただきありがとうございました!
さらっと回答したかったのですが、頭が悪く勉強しているうちにいろいろと混乱してしまいました^^;
参考になるかは分かりませんが、なんとなく参考になれば幸いです。
間違っているところや分からないところがあれば、ご指摘お願します!
⇒https://next-pharmacist.net/archives/2213
こんばんは。
僕は今、薬局薬剤師2年目をやっています。
臨床知識などまだまだ乏しいものがありますが、日々患者さんのためを考えて頑張っています。
医薬品のpkaを知ることは薬物動態、薬物粉砕後の医薬品の安定性や味など延いては患者さんのコンプライアンス、副作用早期発見にも大きく関係する部分なので臨床に多いに役立てる部分だと考えています。
そこで本題なのですが、インタビューフォームの記載などを見ると、医薬品のpkaの値が記載されていますが、塩基性薬物のpkaは酸解離定数でなく塩基の共役酸解離定数(すなわちpkaH)なのでしょうか?
化学構造から明らかに塩基性薬物であることが分かっていても、塩基性薬物がpkaと記載されることに疑問を感じています。
(もちろん中にはプロトン化のpkaと記載してくれる親切なインタビューフォームもありますが)
また似たものにlogPの値も有ります、その値を信じていいのか同じような理由で困ることが有ります。
(有機化学の知識だけで考えればある医薬品がかなりの脂溶性または水溶性をもつはずと考えても実際のlogPの値とは大きく異なる場合があるからです。)
もしそれらの点に関して何かご存知でしたら是非ご教授頂きたく思います。
(周りに化学と臨床を結びつけて考える上司や先輩もいなく常に独学で学習しているのです。。。)
たつきさんへ
コメントありがとうございます。
化学と普段の業務をリンクさせながら、すごく色々と考えていらっしゃって素晴らしいですね!ぜひ見習いたいです^^
で、質問についてですが、僕もあくまでその道の専門家ではないので、正しい答えを期待はしないでください^^
>塩基性薬物のpkaは酸解離定数でなく塩基の共役酸解離定数(すなわちpkaH)なのでしょうか?
まずは、根本として”塩基性”とはどういう意味なのか?ということですよね。水に対しての塩基なのか?塩酸に対しての塩基なのか?によって定義が異なると思います。同じ物質でも溶媒によってpKaは変わりますし^^
「pKa」といわれたらそれはあくまでH+を分子から放出する過程のKaを指しているわけですから、”その分子の酸としての性質”を指すものだと理解しています。そして、H+を出した後、イオンになるか非イオンになるか?それは、その分子の構造によるだろう、ということです。
そこにあまり酸性物質や塩基性物質という概念は必要ないかと思います。(ちょっと抽象的でしょうか。。。)
logPに関しては、具体例を教えていただくと嬉しいです!
ちょっと調べたらlogPにも分子型のみを想定した場合と、イオン型も想定した場合とで、ちょっと考え方が違うみたいです。(もしかしたらヒントになるかも?)
また、logPは分子全体を反映したものですよね。官能基だけでなく、全体として疎水性が強いのか?親水性が強いのか?をみることも大切かもしれません。
すいません、答えになっていません(笑
具体例などあれば一緒に考えましょう^^
回答を頂けただけでも感謝致します。
ありがとうございます。
薬物動態を考える上で非常に大きなヒントになりました!
仰る通り溶媒でpkaの値は変化していきますよね。
その医薬品が胃の中か腸内なのか、血中なのか細胞内なのかなどで分子型かイオン型かは異なりますし、また絶対的に酸性であるとか塩基性であるということはないですね。
その意味において酸性か塩基性かを概念的に捉えるということは重要だと共感しております。(また別の意味でこの会話が通じる薬剤師さんに初めて出会えたことにも感動しています。)
しかし体が中心でなく医薬品の視点で見た場合、解離定数は分子の安定定数とも捉えられ、体内における医薬品のイオン型、分子型の割合が平衡状態にある時に系全体として最も安定である(すなわちΔG=0)点に行くまで反応が進む。
つまり体内がいかなる条件であっても(どのような病気どんな年齢であっても)、どの臓器にあろうと医薬品の医薬品自身は自身が最も安定であるように振る舞うはずです。(話がマニアックになってしまい申し訳ございません)
この法則は酵素でも関与しない限りは必ず成り立つ法則とも言え、普遍的であると言い換えられると思います。
また、たった今ひらめいたのですが、医薬品の分子型が薬の作用に関与すると仮定した場合、薬の投与➡吸収➡分布➡組織➡細胞➡受容体の流れで多くの薬は効くため
細胞での分子の割合を考えたとき、Tmaxから作用時間までのラグがあっても、細胞内での濃度平衡を考えたとき先向きにある程度の予測が可能になることになりますね(もちろん、そこからさらに受容体との親和性などが関与していきますが。。。これは明日から使えるPKPD理論ですね!)
僕はこの法則は臨床判断の根拠に是非活用すべき情報なのではないだろうかと考えております。
これらのことを踏まえ、ヒントを与えて下さったしゅがあさんとの考えを合わせたものをまとめると
・酸性か塩基性かは分子の構造から判断すること。
・pkaの値は溶媒により異なるため概念的に捉えること、値を鵜呑みにすることは危ないが目安としてや分子の安定性を理解する上で十分情報価値がある。
・pkaと医薬品の構造から体内における分子の平衡状態を判断し分子型が多いかイオン型が多いかを判断し薬物動態を判断する。
・薬がいつ効くか?どれくらい効くか?をより正確に判断するためには体全体では定常状態を考え、分子から見た場合は平衡状態を考えるためpkaを用いて、さらに受容体との親和性合わせて総合的に判断するとPKPD理論に迫る情報価値となる。(これ、なんだか数式に出来そうですね。消失速度式とヘンダーソン式とミカエリス式合わせたみたいな。)
その上で患者さんのケアを考えるということになりますね。
本当にすばらしいヒントをありがとうございます!!
僕ももっともっと勉強していつかその理論で患者さんを救ってみせます。
logPに関しては一番僕が疑問に感じているのはその値が成分としてなのか製剤としてなのか?です。
次に疑問になる点が
①成分としての場合ならば
○○塩酸塩などの塩の場合、有効成分の真のlogPの値は異なってくるのでは?という点です。
②製剤としての場合は添加物も入ってくるため情報としての価値が体内に入った後又は粉砕後の素錠などにはほとんどなくなってしまうことが問題である点です。
どちらの場合にせよ、化学構造から脂溶性、水溶性を判断するべきなのか?
などです。
もししゅがあさんの考えがあればご教授お願い致します。
長いコメントになってしまい申し訳ございません。
たつき さんへ
本当熱いコメントありがとうございます。
こうやっていろんな人達があつまって、自分たちの考えていることをシェアできる場をつくりたくて、このサイトをつくったのですごく嬉しいです!
早速、たくさんの情報を教えてもらって感謝です^^
内容もすごく整理されていて、ものすごく勉強されているんだなって伝わってきました^^
何か逆に教えられている感じなのでコメントも恐れ多いのですが(笑)、考えたこと書いていきますね!
僕自身、以前勉強していたときに「酸性」「塩基性」のところで、どこからが酸でどこからが塩基なの?っていう疑問をもったことがありました。そして、僕の中での結論として、「絶対的な判断材料はないかも!」と思っていたところでした。pKaというのは、あくまで薬のまわりを取り巻く環境のpHと相対的にみたときに、分子型orイオン型の割合が予測できるもの(構造式をみた上で)、という認識でいました。
僕の理解は正直なところ、そこで止まっています(笑)。
次の話題として、たつきさんの閃きのところですね。”医薬品の分子型が薬の作用に関与すると仮定した場合、薬の投与➡吸収➡分布➡組織➡細胞➡受容体の流れで多くの薬は効くため細胞での分子の割合を考えたとき、Tmaxから作用時間までのラグがあっても、細胞内での濃度平衡を考えたとき先向きにある程度の予測が可能になることになりますね”
これに関しては、実際にやろうとするとすごく難しいかなあと思います。示していただいた各プロセスにおいて、個々の患者の状態は厳密な意味では異なります。ただ、PPIを飲んでいるから胃内のpHの大幅な上昇がある⇒薬の胃内での構造が変わるということは予想できても、やはり実際に血中濃度、各患者における薬力学的な感受性など数式に落とし込むことは難しいことだなと思います。(現在の技術では)
基本的には、「理論≠目の前のひとりの患者」ですから、数字として厳密に予測することに根本的な意味があるのか?という視点でみたとき、僕は薬物動態の限界を感じています。だからこそ、TDMでも数回にわたる「実際の採血」が必要になるわけです。
でも、可能性はすごく感じます。たつきさんが、そういう視点をもって尽力されれば必ず活用できる場面はでてくると思います!
箇条書きでまとめてくださっている内容に関しては、まったく異論ありません^^
logPは製剤ではなく「成分」のものだと思います。
そして、いくつか薬をみてみたんですが、有効成分として表記のある状態(例:~塩酸塩)の値であると思います。何か別にコメントがあればその通りだと思いますが。。。
例えばトリプタノール。分配係数74.8となっていますが、これはそもそもlogではないかもしれません。pKa9.4でpH7.4・・・?それで油相にいくんですね。。。イオンであれば水相に残る気がしますけど>< う~ん、何か分かったら教えてください!笑
しゅがあさんへ
ご回答ありがとうございました。
今日は半休だったのでその後、思い切ってメーカーに聞いてみました。
「酸化解離定数も分配係数も成分のみでの測定結果である」との回答を得られました。
回答に関してのまとめですが
①pkaに関して
「塩基性の薬物もインタビューフォームではpkaで表記されているため塩基性の強さを知る場合はpka+pkb=pkw=14を利用すること。(つまりpkb=14−pka)」(しかしpkw=14なのは25℃であることにご注意を)
(ちなみに温度とpkwに関しては以下を参考にされると良いかと思います
⇒http://www.keirinkan.com/
kori/kori_chemistry/
kori_chemistry_2/contents/ch-2/2-bu/2-2-3.htm)
②分配係数に関して
「塩の場合もそうでない場合も同様に
原薬をそのまま、オクタノール/水に入れてpHを変動させて有機層にいくか水層に行くかを見て結果を載せている。
そのため塩の場合は有効成分の実際の脂溶性とは異なる場合がある。
塩でない場合は医薬品の脂溶性そのものを表す。
ただしあくまでもinvitroのデーターとなるため物理化学的な目安として考えることである。」
とのことでした。
よって、と言うよりやはりですが
分子の構造を見て
酸性か塩基性か
脂溶性か水溶性かを
判断しなければならないと言うことが分かりました。
(この観点から言えば今後、有機化学の勉強はやり過ぎても損はしなそうですねw)
それを踏まえた上でトリプタノールに関して僕も考えてみます。
トリプタノールのインタビューフォーム(以下IFと略します)を見て見ました。
⇒http://www.msd.co.jp/
Documents/hcp/productinfo/
interviewform/if_tryptanol_tab.pdf
①アミトリプチリンは
構造式から第三級アミンであるため塩基性薬物である。
②IF(5)酸塩基解離定数の記載より
pKa=9.4
構造およびメーカーの回答から考えるとこれはプロトン化アミトリプチリンの酸解離定数である
よってpkb=14-9.4=4.6(より低いpkbを持つ物ほど塩基性度大となる)これは一般的なアミンのpkbですね!
したがってIFの記載はやはりpkaHとするべきですね。
(やはりこれって本当に混乱の原因になっている。。。)
③アミトリプチリン塩酸塩となると
IF(2)溶解性の記載から
「本品 1.0g を水 20mL に溶かした液の pH は 4.5~5.0 である。」
つまり塩酸塩ではアミトリプチリンは
アミンの弱塩基が塩酸の強酸に負けて
全体として酸性の液性を示す。
ということになります。
(つまりアミトリプチリンを水に溶かせば塩基性、アミトリプチリン塩酸塩を水に溶かすと酸性)
で本題のなぜpKa=9.4なのにpH7.4で分配係数が74.8であり油相にいくのか?ですが
IF(6)分配係数の記載より
条件はpH7.4(37°C)、n-オクタノール/緩衝液
まず②の条件から考慮すると
緩衝液のためpH変動はほとんどない(アミトリプチリン塩酸塩の酸性度はほとんど関係ないことになる)
(wikiですみませんが緩衝液にはhttp://ja.wikipedia.org/wiki/緩衝液をご参照いただけるとよいかと)
よって②の条件は無視して問題ない(はず)
つぎに①の条件を考慮すると
pH7.4とはやや弱塩基性の溶液である
アミトリプチリンのpkbは先の計算から4.6(➡pH4,6で分子とイオンが半々の割合になる)
よって7.6ではほとんどが分子型として存在
ゆえにpH7.4で油相になる
こんな感じでしょうか!
わかっちゃいました!僕も感激です!
こんなに考えられるようになったのも今回がきっかけです。ありがとうございます。
ごめんなさい。
②の条件が③
①の条件が②でしたね
記載をミスしてしまいました。
>たつきさんへ
いや~メーカーにまで聞いてくださった詳しい情報ありがとうございます!
いろいろクリアになってきましたね^^
すいません、こっちがおいていかれぎみなんですが(笑
ひとつ質問を!
アミトリプチリンの共役酸はプロトン化アミトリプチリンで、そのpKaが9.4ですよね。
で、pKa9.4って弱酸なので、pKaよりも小さいpH(今であればpH7.4)ではプロトンを放出しない状態、つまりこの場合はイオン型(プロトン化している状態)が多くなるのではないかとイメージしていたんですが、これってどこかで勘違いしているんですかね!?
逆質問多くてすいません(笑
もしよかったらご指摘を!
Next Pharmacist.net 様
はじめまして
もっちと申します。
ありがとうございました。
酸解離定数の解説を拝見いたしましけど、全くの素人で化学を現在、大学で学んでおりますが意味が解りません。両辺の濃度の比は一定条件下では定数となりと云うところなんかも、サッパリです。
ド素人でも解る解説がありましたら、よろしくお願いいたします。
もっちさんへ
コメントをいただきありがとうごさいます。
遅くなってすみませんでした。
正直ちょっと復習していました^^;
「両辺の濃度の比は一定条件下では定数となり・・・」
というところについて、ちょっと解説してみました。
⇒https://next-pharmacist.net/archives/2862
少しでも助けになれば幸いです^^
はじめまして。素人質問で申し訳ありませんがお教え願えれば幸いです。
問.1)高校参考書などにアミノ酸は結晶において、COOHのプロトン
をNH2に渡して分子内塩、別名、双性イオンになっていると
あります。水中でなく空気中でもプロトンの受け渡しができ
るというのでしょうか?
そして荷電符号の付いてないアミノ酸は事実上、この世に
は存在しないのでしょうか?
問.2)同じく参考書にアミノ酸を「酸性の水」や「塩基性の水」に
溶かすと…という記述がありますが、中性でない水というの
が理解できません。水ではなく溶媒の間違いではないでしょ
うか?
参考までにご覧下さい。
問.1)高校参考書などにアミノ酸は結晶において、COOHのプロトン
をNH2に渡して分子内塩、別名、双性イオンになっていると
あります。水中でなく空気中でもプロトンの受け渡しができ
るというのでしょうか?
そして荷電符号の付いてないアミノ酸は事実上、この世に
は存在しないのでしょうか?
答えは難しくありません。
水中ではアミノ酸は双性イオンとして存在します
それが水溶液から見ても、アミノ酸から見ても有利な反応だからです。
なぜ有利になるか?それを分かれば、空気中でイオンとして存在することがアミノ酸にとって有利かを考えてみてみると良いです。
さらに、宇宙でアミノ酸は電解質として振る舞うか?も考えてみてみるとさらに理解が深められると思います。
結局イオンになるか?どうかは系が安定になるかどうかがポイントです。
追加ですみません。
問3.)酸ではないのに(酸でも塩基でもある?)
アミノ酸という命名に困惑します。
IUCAP命名法ではCOOHを持つ化合物の
名前の語尾に「酸」をつけるらしいですが
糖やアミノ酸のような大きなくくりで、し
かも古くからある名称がIUCAP命名法によ
って命名されたとは思えないのですが、な
ぜアミノ酸と命名されたのでしょうか?何
かの誤解から命名された慣用名でしょうか?
>zankiさんへ
ご質問ありがとうございます。自分なりの回答なので、参考程度でお願いします。
問1)ちょっと調べたところ、空気中でも存在できるといった記述がいくつかみうけられました。食塩(NaCl)は結晶(固体・空気中)でイオン的な結合で存在していますよね。双性イオンもそういったイメージで存在できるかと思います。
おそらく分子内での結合に加えて、分子間同士(NH4+とCOO-)でも引き合う力が存在していると予想します。
>荷電符号の付いてないアミノ酸は事実上、この世には存在しないのでしょうか?
瞬間的には存在すると思います。基本的に考えられる構造というのは、多い少ないという違いはあれど存在しています。ただ、非常に近い位置にカルボキシル基とアミノ基がある以上、酸と塩基が反応してしまうのが自然のしくみかと思います。つまりCOOHからプロトンが放出され、隣のアミノ基に受け取られるというのがごく自然な状態ではないでしょうか。
問2)水というのは、「H20」であり、通常それだけで酸性、塩基性に傾けることはできません。(特殊な方法や状況はあるかもしれませんが。)つまり、「酸性の水」というのは「水に酸性物質(塩酸などを少量)を溶かしたもの」を指すと考えて差し支えないと思います。
問3)すみません!あまり「アミノ酸」という命名そのものに違和感を感じたことが正直なかったもので、深く調べたことはありませんでした。アミノ基をもち、さらにカルボキシル基の酸性を反映させた命名かな、と思っています。しかし、αーアミノ酸、βーアミノ酸・・・とあるように、命名の中心?はカルボキシル基なのかなと思います。一応参考までに、アラニンであればIUPAC名としてAlanine、別名として2-Aminopropanoic acidとなっています。
AlanineそのものがIUPAC名として認められているようですね。(間違っていたらすみません!)
以上、浅い解答で申し訳ないのですが、参考になれば幸いです。
もっと詳しい方、コメントなどで訂正、追加などいただければ嬉しいです(笑
速効の回答有難うございます。
>非常に近い位置にカルボキシル基とアミノ基がある以上、酸と塩基が反応してしまう
素人の私には「近い」というイメージが湧きません。原子の直径に比べると両基の距離は結構ありそうな感じに思えるのです。空気中でもその距離を飛び移れるというのは一種の量子現象なのでしょうか?
zanikiさんへ
そういうすごく厳密なところについては僕も素人なので(笑)、あくまで個人的な考えになってしまいます。
確かに、近いといっても置換基間どうしの話なので、一定の物理的な距離はあるかと思います。
そして、ご指摘のように量子論的な視点もあるかもしれません。ただ、この双性イオンになる反応は、カルボキシル基からアミノ基にプロトンが確実に移動している反応です。
なので、電子が非局在化して・・・みたいな話とはまたちょっと違いますよね。
しっかりと移動しちゃっているわけです。しかし、そのプロトンが分子内で移動したものなのか、分子間で移動したものなのかというのは、正直分からないと思います。
分子間であれば、物理的に接触という意味での「近い」ところになることはありますよね。ただ、分子内での反応を考えたときには、ポンっと飛ぶようなイメージにはなるかもしれません。
結晶状態において双性イオンとして存在する・・・これは双性イオンになってから結晶状態(固体)になったのか、結晶(固体)になってから双性イオンになったのか、これも謎です。
前者であれば、水溶液内でカルボキシル基からプロトンが遊離して、分子内にある近いアミノ基にくっついて・・・という自然な流れでイメージできるかと思います。が、固体状態になってから双性イオンになるとすれば、やっぱりポンっと飛んで移動する感じだと思います。
これからちょうど量子論を勉強してみたいと思っているので、また何か分かったらシェアしたいと思います。
zanikiさんも何か分かったら教えてください^^
質問です。
母体血のpHは約7.4とされており、弱塩基性薬物であればpKaが7.4より小さい薬物は母体血(pH7.4)において胎盤に移行しやすい分子型の比率が高い。弱酸性薬物であれば、反対でpKaが7.4より大きい薬物は、母体血において胎盤に移行しやすい分子型の比率が高くなる。
この理解がいまいちできません。具体的な式があれば教えてください。
イメージについては記事でどこよりも分かりやすく説明しています^_^
式がどうのこうのというよりも、このイメージができるか、できないかが重要です。
式を使うなら、具体的な数値を想定して代入してみればよいと思います!
理解できるまで、もう一度読み込んでみてください。