
もっちさん、
ご質問ありがとうございました!
確かに分かりづらかったですね。
すみません。。。
とりあえずご質問にあった箇所の説明をします。
さらに分かりづらかったら・・・
また、つっこんでくださいm(_ _)m
「両辺の濃度の比は一定条件下では定数となり」
のあたりが、まずピンとこないということですね。
では、さっそくいきましょう~!
一定条件下とは、何かというと
実際には
決まった温度で~例えば20℃
決まった溶媒で~例えば水
決まった圧力で~例えば1気圧
ということです。
次に、酢酸(CH3COOH)を
水に溶かした場合を想像してみてください。
CH3COO- と H+に分解(電離)しますよね。
ちょっとここで、
正確な式を一旦示しておきます。
CH3COOH + H2O ⇔ CH3COO- + H3O+
実際にはこういう反応が起こります。
H+は陽子そのものなので、安定には存在できません。
よってH2Oと結合してH3O+(オキソニウムイオン)
として存在しています。(さらに厳密にいうと違うらしい^^;)
ここで、
ひとつ重大な法則がでてきます。
「質量作用の法則」というものです。
名前があまり適切でない、
という話もあるのでネーミングは
あまり気にせずに!
これは何か?というと、
平衡状態にある反応では、
「反応物の濃度積」と「生成物の濃度積」
の比が一定(定数)になるということです。
なんのこっちゃ?
と感じるかもしれませんが、
式にするとシンプルです。
A + B ⇔ C + D
こういった反応があったとします。
これは左右どちらにも進む可逆反応です。
AとBが反応してCとDになるけど、
逆にCとDが反応してAとBになる
という逆の反応も同時に起こっているということです。
自然界ではこういう反応は、
ある時間経つと、左右の反応速度が釣り合って、
みかけ上反応が止まったようになります。
これを化学では化学平衡といって
最も重要な概念のひとつなのです。
そして、化学平衡にある反応式
において、各物質の濃度の間には、
K=[ C ] [ D ] /[ A ] [ B ] という法則が成り立ちます。
Kは平衡定数とよばれていて、
温度と圧力が一定ならば一定値を示します。
要は、両辺の各物質の濃度をかけ算して、
その比をとると、一定になるよ!
という法則です。
で、なんでこうなるの?
さっぱり分からない!
そう思うのであれば、
正常です(笑
ただし、それはだれも知りません。
だから、「法則」なのです。
神のみぞ知る、というやつです。
そんな法則をみつけたから、
これを発見した人はすごいのです。
何が言いたいかというと、
この法則がなぜこうなるか?
を考えても決して答えはでないよ、ということです。
法則として、
これはこういうものだ。
世界はこういう仕組みなんだな、
と理解して、この法則を使っていろいろ考えていくのです。
携帯電話の仕組みが分からないから、
俺は絶対に使わないぞ!
そんなことないですよね?
まず使えるようになるまで、覚えてみるというのが大事です。
そして、いろいろと違う知識がついてきて、
ある時に、あっなるほど!とつながることがあるのです。
ここが勉強のおもしろいところだと思います。
化学平衡という原理そのものは
宇宙のしくみからくるものですが、
上の式自体は熱力学的に説明することができます。
ただ、それを理解にするには、
かなりハードな知識がまた必要になるので
分かるのはもっと先になります!
はい、どんどん話が逸れます笑
では、酢酸に戻ります。
CH3COOH + H2O ⇔ CH3COO- + H3O+
という反応も可逆反応なので、
平衡状態に達して、K=[ C ] [ D ] /[ A ] [ B ]
の式に当てはめることができます。
すると、
K=[CH3COO- ] [H3O+] /[CH3COOH] [H2O]
となります。
ここで、ひとつ「近似」という概念が
入ってきて、[H2O]って水(溶媒)の濃度なんですが、
溶媒の濃度って変化ほとんどしないのです。
これもまた、何で?
ってなるかもしれませんが、
水に少量の酢酸を加えたときをイメージしてください。
そのとき水分子と酢酸分子の量を比較すると、
圧倒的に水分子の量が多いはずです。
なので、反応前後で水の濃度変化はほとんどありません。
ということは、[H2O]は定数と考えよう!となったのです。
で、さらに式を簡単にするために、
K [H2O] = [CH3COO- ] [H3O+] /[CH3COOH]
と変形したのです。
そして左辺をまとめて
K [H2O] = Kaとおいて
Kaは酸解離定数と名付けましょうとなったのです。
一般的な酸性物質の反応として
式を書き直すと、
HA ⇔ H+ + A-
↓
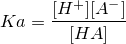
こういう流れですが、
どうでしょう?
少しだけ分かりやすくなりましたでしょうか。
正直、こんなたった一行の説明でも
いくらでも深く掘り下げることができます。
でも、時には
こういう風に式として表せるのね。
って一旦スルーする力も必要です。
世の中には、
なぜそうなるか?
理解できないことがたくさんあります。
でも、そういうことを避けて生きると
逆に選択肢が狭まって窮屈になっていきます。
分からないことは、
分からないこととして先に進む
というのも時に必要になると思います。
で、ある時に、
あのときの疑問はこういうことだったんだ!
って感動が必ずあります。
その感動は、
あきらめないで学ぶことを続けた人
にだけ訪れます。
では、長くなりました!
分かりづらかったすいません^^;
ありがとうございました!
コメント
一般的な酸性物質の反応として
式を書き直すと、
HA ⇔ H+ + HA-
↓
A-
の間違いでしょうか?
細かくてすいません.
すいません,スペースは反映されないのですね;
訂正
一般的な酸性物質の反応として
式を書き直すと、
HA ⇔ H+ + HA-
↓
HA ⇔ H+ + A-
の間違いでしょうか?
ご指摘ありがとうございました!
助かりますm(_ _)m
訂正しましたので、また変なところあったら教えてください^^
KとKaの違いがわかりました。[溶媒]が左辺移動してたんだ。そうだたのか。
計算問題で悩んでいたんです。ありがとう。
はっぱ 様
コメントをいただきありがとうございます。
励みになりました!
ずっとモヤモヤしていたのがすっきりしました!
ありがとうございます( ;∀;)
とっとさん
お役にたててよかったです^^
コメントありがとうございました!